アオコの有毒物質の化学
─構造解析と高精度分析手法の開発─
Summary
アオコを形成する藍藻類の中には有毒物質を産生する種類があり、様々な構造を持つ有毒物質が報告されています。 研究所ではアオコが産生する有毒物質による健康被害を抑制するために、アオコが産生する有毒物質の構造を解析するとともに、簡便・迅速で精度の高い分析手法の開発を行ってきました。
アオコが産生する有毒物質の構造解析
有毒物質の性質を理解するためには、まずその化学構造を知ることが大切です。アオコが産生する有毒物質であるミクロシスチンの構造は1980年代中頃に決定されました。その後、ノーベル化学賞も受賞した2次元核磁気共鳴(NMR)を含む化学分析の進歩により1990年代初めころには70種類以上のミクロシスチン同族体の構造が決定されていました。
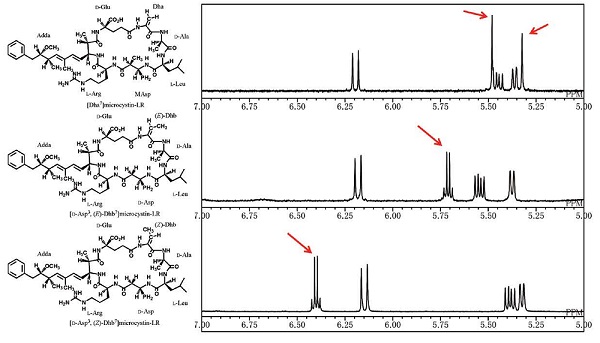
研究所でも1990年代からアオコが産生する有毒物質について研究を行っていて、一つの藍藻株について数百リットル培養しては有毒物質を抽出・精製し、構造解析をしてきました。1995年にはスコットランドの株保存施設から預かった藍藻株の中から、新しいタイプのミクロシスチン類を見つけることができ、Dhb-ミクロシスチンと命名しました(図3)。Dhb-ミクロシスチン類はNMRスペクトルでは特徴的なパターンを示しますが、当時一般的に行われていた質量分析による解析では区別が難しく、発見が遅れたものと思われます。さらに、Dhb-ミクロシスチンの中にはNMRでしか区別できない幾何異性体の同族体も存在していて、NMRによる解析が重要であることを認識させられました。また、Dhb-ミクロシスチンはグルタチオン抱合による解毒を受けにくいことが知られていて、発がん物質である可能性も指摘されています。現在までに11種類のDhb-ミクロシスチン類が報告されていますが、研究所ではそのうちの9種類についてその構造を決定・報告してきました。
ミクロシスチン以外では、1993年には魚毒性を示すチオンスルフォリピドの単離・構造解析、2011年には筑波大学の彼谷教授のグループと共同で環境ホルモン作用が疑われている7-ヒドロキシレチノイン酸の単離・構造決定も行っています。
アオコが産生する有毒物質の毒性評価手法の開発
有毒物質は構造とともにその毒性(強さ、作用機序)に関する研究も大切です。ミクロシスチンは哺乳類では肝臓に特異的に取り込まれ、急性肝炎を起こすことが知られていて、ミクロシスチンの毒性はマウスに注射して調べられていました。
しかし動物実験を行うことが難しくなってきたことから、培養細胞を使った毒性試験法の開発を試みました。1996年には、電気刺激により細胞膜に穴を開けて強制的に細胞に取り込ませるエレクトロポレーションという手法により、本来はミクロシスチンを取り込まない培養細胞を使って毒性評価をする方法を開発しました。また、平成19~21年度には沖縄県の株式会社トロピカルテクノセンターとの共同研究で、遺伝子操作により安定性を高めた蛋白質脱リン酸化酵素(PP2A)を利用した毒性評価(定量)手法の開発も行いました。
さらに、平成21~23年度には、国立医薬品食品衛生研究所との共同研究において、冷凍状態で市販されている初代培養肝細胞を用いるとともに、定量的NMRで濃度をきちんと把握したミクロシスチン同族体を使うことにより再現性の良い毒性評価を行い、ミクロシスチンによるリスクの評価手法を確立しました。
アオコが産生する有毒物質の分析手法の開発
有毒物質の構造と毒性が解明されたら、そのリスクを評価するために有毒物質の量を測定する分析手法の開発が重要になります。研究所がミクロシスチンに関する研究を始めた頃にはすでに70種類以上のミクロシスチン類が報告されていましたが、標準品は6種類ほどしか市販されていなかったことから、まずミクロシスチン類の総量を測定する手法の開発を試みました。ミクロシスチン類のAddaと呼ばれる共通構造を酸化することによりMMPB(3-メトキシ-2-メチル-4-フェニル酪酸)とし、生成したMMPBを測定することでミクロシスチンの総量を測定する手法を1992年に開発しました(MMPB法)。この手法は、現在でも生物試料中や湖沼の底質中のミクロシスチン類を測定する手法として、世界中で利用されています。
MMPB法はミクロシスチン総量を測定する手法ですが、世界保健機構(WHO)が勧告したミクロシスチンの暫定基準値はミクロシスチン-LRという一つの同族体についての基準値だったことから、同族体を個別に測定する手法も開発されてきました。その中でも高速液体クロマトグラフ-タンデム型質量分析計(LCMS/MS)を用いる手法が同族体の同定および分析感度で優れています。ただし、この手法の弱点は測定時の夾雑物等によりイオン化する効率が不安定なことでした。この弱点の克服には、安定同位体で標識された化合物を使うのが一般的ですが、市販品はありませんでした。研究所ではミクロシスチンを作る藍藻株を窒素の安定同位体(15N)を含む培地中で培養することで、ミクロシスチン中の窒素(通常は14N)を効率よく安定同位体(15N)に置き換えることができることを見つけ、大量培養により15Nを含むミクロシスチンを調製しました。この15Nで標識したミクロシスチンを内部標準物質として測定したい試料に添加して分析することにより、精度良くミクロシスチンの分析を行うという手法を2010年に世界に先駆けて報告しました。今では、15N標識ミクロシスチンが市販されているので、15N標識ミクロシスチンを用いた高精度分析手法が日本国内のみならず世界の標準的な分析手法となることを期待しています。
また、有毒アオコへの対処を実際に担当される地方自治体の環境研究所と共同研究も行っていて、宮城県保健環境研究所、千葉県環境研究センター、奈良県景観・環境総合センター、福岡県保健環境センター、佐賀県くらし環境本部環境センター、沖縄県衛生環境研究所の研究者の方々と有毒アオコのモニタリング手法について検討を続けています。























