研究者に聞く!!
Interview

小池英子(写真左)
環境健康研究領域 生体影響評価研究室主任研究員
井上健一郎(写真中央)
環境健康研究領域 生体影響評価研究室長
柳澤利枝(写真右)
環境健康研究領域 生体影響評価研究室研究員
環境健康研究領域 生体影響評価研究室主任研究員
井上健一郎(写真中央)
環境健康研究領域 生体影響評価研究室長
柳澤利枝(写真右)
環境健康研究領域 生体影響評価研究室研究員
小児をはじめとして、アレルギー性疾患を発症する人たちが増加しています。その原因の1つに、化学物質など生活環境に放出されることで生体に悪影響を与える物質(環境汚染物質)の曝露が考えられています。一方で、化学物質のアトピー・アレルギーへの影響に関する研究は、充分には行われていません。今回は、主として動物実験によって、環境汚染物質がアレルギー性疾患に与える影響とそのメカニズムの解明に関する研究に取り組んでいる井上さん、柳澤さん、小池さんに、研究の成果や今後の進め方などについてお聞きしました。
アレルギー性疾患の症状を悪化させる環境化学物質の存在
1: 先進国で急増するアレルギー性疾患
-
Q: まず最初に、研究者になったいきさつを教えてください井上: 大学院生時代、炎症や免疫にかかわる研究がしたかったのですが、研究テーマがそれとは少しずれていました。それに、研究に使える時間が少なく、なかなか没頭できませんでした。
そんなとき、当時の研究所で研究室長をされていた高野裕久先生(現、環境健康研究領域長)からお誘いがあり、(大学院の)途中から国立環境研究所の共同研究員として活動することにしました。その後、正式に研究所の研究員となり、現在に至っています。
柳澤: 大学4年生のとき微生物学を専攻しており、微生物による環境中の汚染物質の分解・除去、またその代謝経路の解明について研究していました。この研究の過程で、環境中の汚染物質が実際に健康にどういった影響を与えるのか、ということに関心を持ち、修士課程のときに動物を用いた影響評価ができる所を探そうと思いました。そこで、大学でこうした研究をしているところを訪ねたところ、当時からディーゼル排気微粒子(Diesel Exhaust Particles:DEP)の健康影響について研究をしていたこの研究所を紹介されたのです。これが縁となり、2000年から改めて研究に携わらせて頂くことになりました。
小池: 私は自分自身がアレルギー体質のところがあり、子供の頃から漠然と、なぜそういうことが起きるのだろう?と疑問に思っていました。それがきっかけで、近年のアレルギー疾患の増加と環境因子の関係について関心を持つようになりました。そこで、大学の卒業研究のとき、この研究所を紹介され、大学院の博士課程まで、オゾンや二酸化窒素といったガス状の大気汚染物質が呼吸器・免疫系に及ぼす影響についての研究をしました。そして学位取得後も研究員として、環境汚染物質のアレルギー増悪メカニズムの解明に向け研究に取り組んでいます。 -
Q: アレルギーに着目した化学物質のリスク評価に取り組んだ経緯を教えていただけますか。井上: この10数年、日本ではアレルギー性疾患を発症する人が急増しています。その背景として、環境の変化が考えられたからです。
-
Q: なぜ、そう断言できるのでしょうか。井上: 疾患が急増した背景としてはヒトの遺伝子の変異という内的なものと、環境の変化という外的なものの2つが考えられますが、内的なヒトの遺伝子については10数年という短期間ではそれほど変異しないからです(図1)
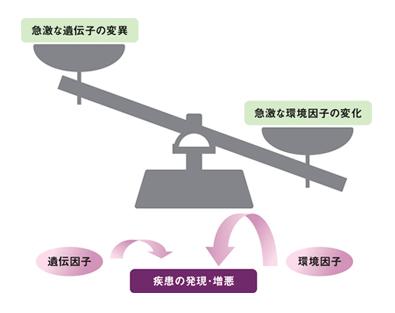
図1 アレルギー性疾患急増の背景
-
Q: 化学物質のリスク評価に関する研究の現状を教えていただけますか。井上: 近年、野生動物での生殖腺異常などの増加を受け、性ホルモン濃度(活性)を中心とした検査を実施した結果、ホルモンのような活性を持つ物質の存在がクローズアップされるようになり、環境中の化学物質による内分泌・生殖器系への影響が報告されるようになりました。また「シックハウス症候群」「シックスクール症候群」といった疾患の増加への関与も示唆されているほか、アトピー体質の人はシックハウス症候群にかかりやすい、シックハウス症候群の患者さんは高い確率でアレルギー性疾患を合併することも知られるようになりました。化学物質は内分泌・生殖器系、免疫・アレルギー系を含んだ高次の生体制御機能に影響を与える可能性があるわけです。
にもかかわらず、環境化学物質がアレルギー性疾患に与える影響に関する研究は、国内外を問わず充分には行われていませんでした。こうした現状から、化学物質がアレルギー性疾患に与える影響の研究に取り組むことになりました。 -
Q: アレルギー性疾患が急増しているのは日本だけの現象なのでしょうか。井上: いいえ。日本以外の国でも、とくに先進諸国では増加が認められています。
-
Q: ところで、この研究ではどういった化学物質を評価されたのでしょうか。井上: まず、大気汚染物質の1つであるDEP、プラスチックを柔らかくする可塑剤として使われるフタル酸ジエチルヘキシル(DEHP)に着目しました。
DEPは炭素粒子と数百~数千種類にわたる化学物質、金属化合物の混合物で、さまざまなアレルギー性疾患の症状を悪化させるものとして世界的に知られています。しかし、その中のどの成分がこれらの症状を悪化させるのかまでは、まだわかっていませんでした。
そこで、研究をスタートするに当たって、どういった成分がアレルギーを悪化させる原因となっているのかを順を追って調べることにしました。その結果、DEPの表面に付着している脂溶性化学物質成分が怪しいことがわかりました。その中のフェナントラキノン(PQ)やナフトキノン(NQ)といったキノン系化学物質は、細胞レベルでの毒性は確認されていますが、動物個体に対する影響の知見がありません。そのため、研究では混合物としてのDEPのほか、DEPから抽出したPQ、NQを含んだ化学物質も評価対象としました。
柳澤: DEHPについては、マウスなどのげっ歯類を用いた実験から、生体内のホルモン物質と同じような作用を示す環境ホルモンの1つである可能性が報告されています。一方、環境ホルモンは、免疫機能に対しても影響を及ぼす可能性が指摘されていますが、そのメカニズムなど、具体的なところはまだわかっていません。そのため、最初は環境ホルモン物質の評価に着手することになり、まずはDEHPを選択した次第です。 -
Q: 今回の研究における皆さんの役割分担を教えてください。井上: 主に私がアレルギー性喘息、柳澤さんがアトピー性皮膚炎での化学物質の影響評価を担当しています。そして小池さんには2007年4月から、動物実験の結果を裏づけるための細胞レベルでのメカニズムの解明を担当していただいています。
2: 低濃度の曝露でも症状は悪化
-
Q: 研究は主に、どのようにして進めていくのでしょうか。井上: まず動物疾患モデルをつくり、評価したい化学物質を一定期間投与した後、その化学物質によってどの程度疾患が悪化したのかを評価します。また、化学物質の影響を早く、簡単、適正に評価(スクリーニング)するために、in vivo(生体内)試験の新たな手法の開発も、研究と並行して行いました(図2)。
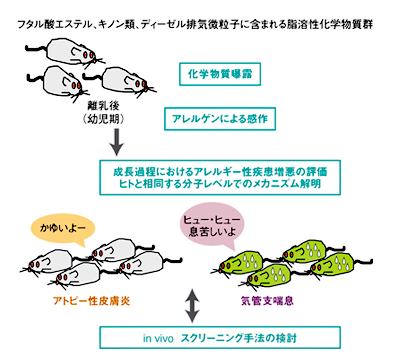
図2 研究全体のスキーム(枠組み)
-
Q: 「動物疾患モデルをつくり」とおっしゃいましたが、これはどういう意味なのですか。井上: 人間の疾患に類似する症状を示す実験動物を作製するということです。アレルギー性喘息に関するものであればアレルギー性喘息モデル、アトピー性皮膚炎に関するものであればアトピー性皮膚炎モデルをつくります。
モデルに使う動物は、疾患によって異なります。たとえば花粉症であればモルモット、アレルギー性喘息やアトピー性皮膚炎であればマウスを主に使います。私たちの研究では、アレルギー性喘息とアトピー性皮膚炎の動物モデルにマウスを使っています。 -
Q: それから、研究と並行してin vivo試験の新たな手法を開発されたそうですが、その理由は何ですか。柳澤: 今回はDEPやPQ、NQ、DEHPを評価しましたが、今後、他の多くの化学物質を評価するには、従来からある動物試験方法では時間や感度などの面で問題があったからです。今回開発したin vivo試験の新たな手法は、3週間で影響を評価することができ、それまでの動物試験に比べてはるかに短期間で評価できました。この成果は、環境関連の学術雑誌であるアメリカの“Environmental Health Perspectives”誌にも掲載されました。

-
Q: 症状が悪化したかどうかは、どのようにして判断されるのですか。井上: アレルギー性喘息の場合は、肺の炎症に関係する白血球の分析と、アレルゲンに対する抗体が血液中にどれだけ産生されたかを調べて判断します。まず評価したい化学物質を投与した後、マウスを解剖して肺の中を生理食塩水で洗い、気道に表出した白血球の種類と数を調べます。この解析により炎症の程度を判断することができます。また、血液中にある異種タンパク質に対する抗体を調べるのは、抗体がどの程度つくられたかによってアレルギー症状の程度が推測できるためです。
柳澤: アトピー性皮膚炎では、まずダニからの抽出物(ダニアレルゲン)を計8回、マウスの耳に注射し、この間4回にわたって腹腔内にDEHPを曝露します。症状の変化は、アレルゲンを投与した翌日に腫れや引っかき傷、乾燥、発疹といった4つの状態を肉眼で確認します。肉眼での評価は、評価者によって評価にばらつきが生じることも考えられますので、評価項目にはすべて基準を設けました。腫れに関しては、厚みをレバー操作で簡単に測定できるハンディタイプの測定器で耳を挟み、数値化も行います(図3)。また、最終的にダニ抽出物の投与で炎症を起こしている耳の組織を採取し、アレルギー性喘息モデルと同様にそこに集まる白血球の種類や数を調べたり、どのようなタンパクが産生されているかを調べたりします。
-
Q: 研究の結果、とくに目立った所見を教えていただけますでしょうか。井上: DEPを元素状炭素成分と脂溶性化学物質成分に分け、それぞれをマウスに投与したところ、元素状炭素よりも脂溶性化学物質の方が、アレルギー性喘息の症状・病態を悪化させることがわかりました。また、脂溶性化学物質成分に含まれるPQやNQを投与したときも同様に、症状が悪化するという結果になりました。
しかし、最もアレルギー症状を悪化させたのは、DEPそのものを投与したときでした(図4)。つまり、様々な成分の混合物としてのDEPが、アレルギー性喘息の悪化に最も寄与しているといえます。
柳澤: 研究では、1回あたりのDEHP投与量を0.8、4、20、100μg動物/週の4段階設定し、影響を評価しました。投与量は1日あたりに換算すると、4.8、24、120、600μg/kg/日に相当しますが、これらはDEHPの毒性が認められないとされる最大量の19mg/kg/日よりかなり低濃度です。1日の予測摂取量が6μg/kg/日、最大で40μg/kg/日との報告もあることから、今回の設定濃度はヒトが1日で摂取し得る濃度と言えます。実験の結果、最も症状を悪化させたのは、20μgを投与したときでした。一方、100μgを投与したときは、逆に症状を悪化させなかったのです(図5、6)。
環境ホルモンの中には、高濃度になると影響が消失する逆U字形の反応曲線を描くものがいくつかありますが、DEHPもこれに類似した反応曲線でした。このメカニズムの解明については今後の検討課題であり、細胞レベルでの研究結果と合わせて検討していく必要があります。しかしいずれにしても、DEHPが国内における1日予測摂取量と同じぐらいの濃度でアレルギー症状を悪化させ得る結果が得られたことは、非常に重要です。
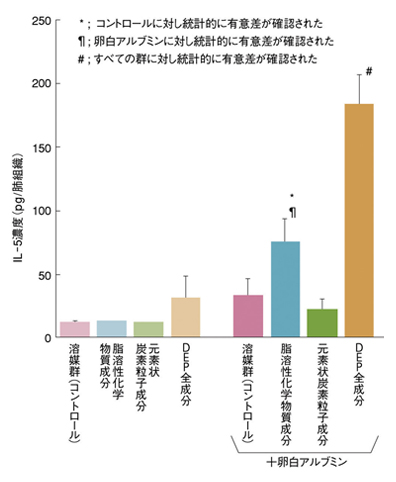
図4 DEP曝露がアレルギー性炎症に関わるタンパク(IL-5)の肺における発現に及ぼす影響
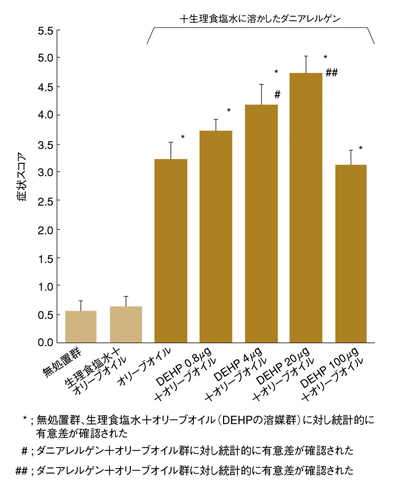
図5 DEHPがアトピー性皮膚炎に及ぼす影響(スコア)

図6 DEHPがアトピー性皮膚炎に及ぼす影響(肉眼所見)
3: 簡便かつ鋭敏な影響評価手法の確立
-
Q: 研究者として、研究の成果を社会に還元することは考えられているのでしょうか。井上: 研究者としてできることは、今後も適正な影響評価を行うことです。どんな化学物質が健康に悪影響を与えるか、ということを報告し、成果を社会に還元していければと思います。そのためには、症状を悪化させる仕組みを細胞レベルで解明し、動物試験の結果をきちんと裏付けなくてはなりません。動物試験、細胞試験の両方を並行して行い、なおかつ相関させながら、健康への影響評価を包括的に進めていくことが大事になります。
-
Q: そうすると、今後は小池さんの研究が重要になってくるわけですね。小池: 現在、免疫を担う細胞の1つで、体内に侵入してきた異物を処理し、その情報をリンパ球に伝える機能(抗原提示機能)を持った、免疫応答に重要な抗原提示細胞を、アトピー性皮膚炎モデルで使用しているマウスから採取し、さまざまな解析を行っています。抗原提示は、アレルギー反応に至る最初のステップとして要です。このことから、抗原提示細胞の活性化は、化学物質の影響を評価する上で良い指標になると考えています。この実験では、細胞を培養する際に、そこにDEPやDEHPなどの化学物質を単独、もしくはアレルゲンと複合させたものを添加し、細胞がどのような機能的変化を起こすのかについて検討していきます。
現在、化学物質が抗原提示細胞の機能をどのように変化させるのか、といったアレルギー疾患の発症・増悪メカニズムの解明を急ぐと同時に、抗原提示細胞を用いた影響評価手法の確立をめざしています。この影響評価手法に関しては今年度中に確立し、その後は抗原提示細胞以外の免疫担当細胞を用いた影響評価手法も順次検討していく予定です。 -
Q: メカニズムの解明と同時に、影響評価手法の確立も並行して行う形になるのですね。小池: そうです。一般的に言えば、動物個体を用いた生体内(in vivo)試験は最小限の個体数にとどめているとはいえ多くの動物が必要で、なおかつ実験が長期間に及ぶことから、多数の化学物質を評価することは非常に困難です。それに対し、細胞を用いた試験管内(in vitro)試験は、短期間で同時に複数の化学物質を評価することが可能です。このことから、in vivo試験の結果を反映する簡便かつ鋭敏なin vitro試験法を確立することが重要と考えています。また、動物愛護の観点から見ても、in vitro 試験の確立には意義があります。
柳澤: 現在、小池さんがin vitro 試験法を開発していますが、ただし、これが確立されても動物試験は並行して行うことになります。それは、細胞レベルの評価は生体内で実際に起きる変化を把握するのに必ずしも充分ではなく、よりヒトに近いところでの生体を用いた評価が必要だからです。 -
Q: それでは最後に、今後の研究の進め方についてお聞かせいただけますでしょうか。井上: まだ評価していない化学物質がたくさんありますので、今回評価した化学物質の研究を、毒性メカニズムの解明を中心に継続しながら、評価対象とする化学物質を拡大していきます。
また、今回はアレルギー性喘息とアトピー性皮膚炎への反応から化学物質の健康への影響を調べましたが、これからは肥満、糖尿病、高血圧などの生活習慣病に対する化学物質の影響にも領域を広げていければと考えています。
コラム
-
身近になった化学物質の曝露アレルギー性疾患が急増している背景の1つとして、私たちを取り巻く環境が急速かつ大きく変化し、化学物質をはじめとする環境汚染物質に触れる機会が増えたことがあげられます。種々の環境因子別に見た化学物質に関する近年の変化点を、以下にまとめます。
(1) 居住環境の変化
木材などの建材の防腐や防虫を目的に種々の化学物質が使用されるようになったほか、化学物質を含んだ壁紙や塗料、接着剤、パーティクルボードなどが住宅に多く使われるようになりました。
(2) 食環境の変化
人体に深刻な影響を与える化学物質の使用は減少したものの、食の多様化が進んだことでさまざまな化学物質を含んだ食品を摂取する機会が増えました。さらに、使い捨て食器や容器では、よくプラスチックが使用されますが、その中には材質を柔らかくする可塑剤としていくつかの化学物質が使用されています。
(3) 衛生環境の変化
いわゆる抗菌グッズが増加したことが象徴するように、抗生物質や抗菌性化学物質などが普及するようになりました。
(4) 大気・水・土壌環境の変化
この場合の変化は大気や水質、土壌が汚染されることを意味します。
とくに世界中の都市部の主たる大気汚染物質であるDEPは、一般的に元素状炭素を核として持ち、その周辺や内部には炭素数が14から35の炭化水素とその誘導体、キノン、多環芳香族炭化水素、飽和脂肪酸、芳香族酸、など多くの物質が存在しています。多様性に富んだ化学物質の集合体がDEPなのです。
-
マウスを使った動物実験この研究では、マウスを使った動物実験を繰り返し行い、評価を重ねています。
アレルギー性喘息で化学物質の影響を評価する場合、マウスが持っていない異種タンパク質(卵白アルブミン)をアレルゲンとして投与し、短期間で意図的にアレルギー性喘息と似た症状を発症させます。また、マウスにはDEPやPQ、NQと評価したい物質を気管から投与し、のべ1カ月半にわたり評価したい物質を曝露します。
一方、アトピー性皮膚炎での影響評価は、NC/Ngaマウスの耳(耳介部)にダニアレルゲンを生理食塩水に溶解して注射、アトピー性皮膚炎に似た症状を短期間で発症させ、DEHPを腹腔内に投与します。1回の実験期間は3週間程度と動物実験として投与は比較的短期間です。

-
新たな in vivo 試験法の開発疾患の影響評価に関する動物実験に当たっては、まず動物に疾患を発症させることが必要です。アトピー性皮膚炎モデルでは、一般的に自然発症、あるいはタンパクと結合して抗原性を発揮するハプテンという物質を塗布して皮膚炎を発症させる方法がありますが、動物試験としてはいくつかの問題点がありました。
まず、これら2つの方法は評価できるようになるまでに長い時間を要します。飼育期間が長くなると、飼育環境やマウス同士の相性などによって症状の出方に差が生じやすく、正確な症状の把握が困難でした。また、ハプテンを塗布する場合は、比較的重度の皮膚炎を発症するため、化学物質との複合的な影響を検討するには感度などの面で問題がありました。そこで今回の研究では、動物個体を用いた新しい生体内(in vivo)試験法を開発することにしました。
この研究で開発した生体内試験法の最大の特徴は、疾患を引き起こす原因物質を直接投与し、短期間で疾患を発症するようにしたことです。これまでの試験法より、影響が評価できるようになるための時間を短縮することが可能で、実験では3週間程度で影響を評価することができました。in vivoとはラテン語で「生体内(動物個体内)」という意味で、動物実験で一般的に用いられる言葉です。
しかし、早く評価することが可能になったとはいえ、まだ時間がかかる、一度に複数の物質を評価する場合には向かない、といった面があります。そのため現在、生体外(in vitro)試験法の確立も並行して進めています。


