コラム「酸性雨1」
成り立ち
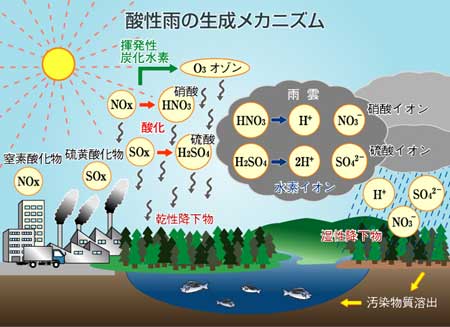
工場や自動車などのエネルギー源である化石燃料(石炭,石油など)を大量に使用することで大気中に多くのSOxやNOxなどが放出されます。それが光化学反応などにより,酸性物質(硝酸,硫酸)に変化します。酸性雨は,これら酸性物質が溶け込んだ雨,と一般には知られています。雨以外の霧や雪に溶け込んだ場合には,酸性霧,酸性雪などといわれますが,本質的には同じものです。
pHとの関係
pHは酸性・アルカリ性の単位で,7.0が中性です。
雨にはもともと大気中の二酸化炭素が溶け込んでいるため,やや酸性を示します。したがって人為的汚染によるSOx,NOxのない環境中の雨はpH5.6程度といわれています。ただし,自然界では噴火などの火山活動で酸性のガスが放出され,pH5くらいまで下がることがあります。このため,人間活動の影響により酸性化が起こっているとはっきり指摘できるのは,日本ではpH5以下の場合だといわれています。
酸性雨問題とは
広い意味で用いられる酸性雨問題には、雨水の酸性化以外にもいろいろな問題が含まれています。たとえば,黄砂のようにアルカリ土壌を含んだ粒子状物質が大気中に巻き上げられ,酸性雨中の硫酸(H2SO4)などと反応して中和された場合には、雨水としては中性を示しますが硫酸イオンなどは残っており,決してなくなったわけではありません。雨水が汚染されたかどうかについてはpHだけで判断するのではなく,雨などに含まれる汚染物質の量にも注意が必要です。
また,汚染物質は雨に溶け込むだけではありません。ガスや粒子として直接地上に舞い降りてきます。広義の酸性雨問題には,こうした現象も含まれます。つまり,「酸性雨」とは酸性の雨だけではなく,人間活動から発生した大気汚染そのものの問題なのです。それら大気汚染物質が,形を変えて落下し,地上に影響を及ぼすのです。