空中浮遊微粒子(PM2.5)の心肺循環器系に及ぼす障害作用機序の解明に関する実験的研究(特別研究) 平成11~13年度
国立環境研究所特別研究報告 SR-47-2002
1.はじめに
近年、我が国の大気汚染は、従来の硫黄酸化物(SOx)や降下煤塵を中心とした固定発生源型汚染から大都市、幹線道路沿いなどにおける二酸化窒素(NO2)や浮遊粒子状物質(SPM)を主体とした移動発生源型汚染に移りつつある。中でもディーゼル車の増加が著しく、大都市部のSPMとNO2の環境基準の達成率は依然低い状態にある。
浮遊粒子状物質(SPM)の汚染は深刻で、例えば東京都内の自動車沿道排気測定局(自排局)で環境基準を満たしているところは少ない(平成8年度から12年度までの達成率は9.3%~63.4%)。また、東京都内のSPMの総排出量は年間1万トン以上にもなり、その約半分は粒径2.5μm以下のディーゼル排気微粒子(DEP=PM2.5)である。
また、最近になって、粒径が2.5μm以下のSPM、すなわちPM2.5と心疾患による死亡率との間に非常に高い相関性が存在することがアメリカやイギリスでの多くの疫学研究によって示され、その健康影響の重大性がにわかにクローズアップされてきた。しかし、この両者間の因果関係の実験的証明はまだなされておらず、その証明はこれからの研究にかかっている。
このため、PM2.5と心肺循環器疾患との間の因果関係を実験的に明らかにすることは、微粒子汚染の健康影響をより明確にすることになり、緊急性の高い重要な研究分野であることが指摘されている。このような背景を踏まえ、本研究では、日本の大都市部のPM2.5の主要部分を占めるDEPを対象物質として、ディーゼル排気の曝露実験と組織培養を含む in vitro の実験を組み合わせることにより、そのDEPがどのような機序で心肺循環器系に障害を及ぼしているかを明らかにすることを目的とした。このことにより、大都市部におけるPM2.5(DEP)汚染を低減することの緊急性と重要性に関する科学的知見を示し、環境保全のための科学的資料を提供する。
2.研究の概要
本研究に先立って、昭和63年度から平成4年度に実施した特別研究において、DEPが(1)気管支粘膜下への好酸球の浸潤を伴う慢性気道炎症、(2)気管支での粘液の過剰合成、分泌、(3)気道過敏性の亢進などに相当する呼吸器系の病態を発現することを示した。次に、平成5年度~平成9年度に実施した第二次特別研究において、DEPがアレルギー性のぜん息様病態を増悪すること、そのメカニズムとして好酸球の浸潤に基づくアレルギー反応の亢進が考えられることを明らかにした。
そこで、本研究は、先の2つの特別研究で行った呼吸器系疾患およびアレルギー性疾患等の成果に基づき、最近の疫学的調査で重要視されている循環器系に対する影響の解明とそれに関する免疫系に対する影響を解明することに主眼をおいている。
本報告では、空中浮遊微粒子(PM2.5,DEP)の心肺循環器系に及ぼす障害作用を明らかにするために、1.循環器に対する影響の解明研究として、(1)PM2.5(DEP)の曝露を受けた動物の心電図解析をはじめとする電気生理学的解析、(2)心臓と肺の病理組織学的変化の解析(in vivo 実験)、(3)それらの組織にとって重要な各種構成細胞に対するPM2.5(DEP)の影響を解析(in vitro 実験) するとともに、 2.呼吸循環影響に関する免疫学的研究として、(4)肺胞マクロファージの反応、(5)鼻アレルギー反応および(6)感染性肺傷害の憎悪とメカニズムの解明(in vivo 実験)の実験を行った。
I 循環器系に対する影響
(1)ディーゼル排気(DE)吸入曝露ラットにおける心電図および各臓器の病理組織学的検索
DEPの循環器に及ぼす影響を明らかにするための第一段階として、チャンバー内でDEPを含むディーゼル排気(DE)に曝露したラットの心電図検査、体重測定、臓器重量測定および臓器の病理組織学的検索を行い、DEPの吸入曝露による循環器系および各臓器への影響を調べることを目的とした。
DEの吸入曝露実験は本研究所内に設置されている大型吸入曝露システムを用いて行った。吸入曝露のためのチャンバーは4台使用した。各チャンバー内の平均DE濃度は0.3、1.0および3.0mg/m3になるように設定した。これらの濃度は日本のSPMに関する環境基準値0.1mg/m3のそれぞれ3、10、30倍に相当する(実際の曝露時間は12時間なので、1日の平均曝露濃度はそれぞれ0.15、0.5および1.5mg/m3の濃度になる)。また、対照として清浄空気のみを吸入させるチャンバー内での曝露も行った(対照群)。曝露チャンバー内の粒径と粒子の重さの関係から粒径の平均値は0.28~0.32μmと推定された。しかし、粒径と粒子数の関係から、粒子数は0.1μmのいわゆるサブミクロンより小さい粒子が多く出ていることが判明した。このことは、軽くて小さい粒子が多く曝露チャンバー内に入り、動物に曝露されていることを示している
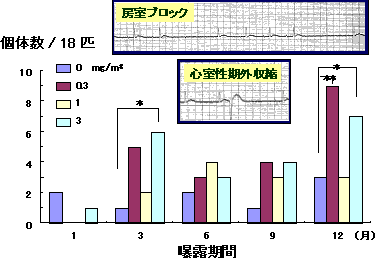
1)異常心電図波形および不整脈の出現(図1)
DEに1、3、6、9、および12ヶ月間曝露させたラットの心電図を測定した結果、曝露群で異常心電図の発現数の増加がみられた。その異常心電図のほとんどは心室性期外収縮であり、曝露期間が延長するほど、この不整脈の発現数および不整脈を発現する個体数に増加する傾向が認められた。心拍数は曝露期間が長期化すると曝露群において有意な増加が認められた。DE曝露によって異常心電図が発現しやすくなった状態がつくられているものと考えられる。また、12ヶ月曝露群では中程度の房室ブロックを呈する個体が認められた。
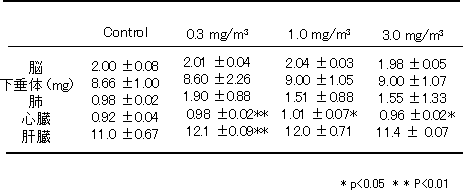
2)体重および臓器重量の変化(表1)
体重は、12ヶ月曝露において、いずれも3.0mg/m3曝露群で対照群に比べて有意な減少を示した。各臓器重量を測定した結果、12ヶ月曝露後のDE曝露群の心臓重量は対照群に比べ有意に増加しており、組織学的検索では曝露群の心臓に著しい変化は認められず、重量増加の原因は不明であるが、DE曝露が心臓の形態に影響を及ぼしたことが推察される。
3)心室壁の厚さの変化(図2)
心臓について、冠状動脈に平行に心室壁の最大部を切断し、左心室と右心室の室壁の厚さを測定した。その結果、右心室の壁の厚さが曝露群で有意に厚くなり、心筋内の刺激の伝導の仕方が変化していることを推測させた。
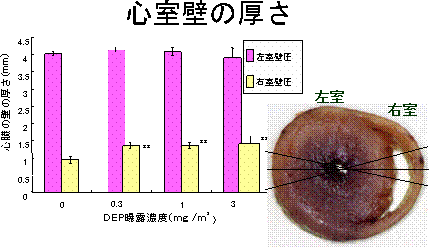
右の図は心臓の断面を示し、左室の中心から長軸方向に3本の線を引き、
線と交差する3点の心室壁を測定して平均値を心室壁厚とする。
**p<0.01の有意差を示す。
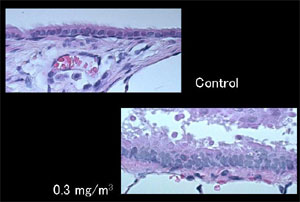
4)肺および気管支の組織の変化(図3)
組織学的検索では、曝露群の肺胞内において多数の黒色粒子状物質およびそれらを取り込んだ肺胞マクロファージを多数認めた。それらのマクロファージは肺全体に散在していたが、DE濃度が高い群ほど肺辺縁に集まる傾向を認めた。肺における高度な炎症反応や水腫などはいずれの曝露群でもみられなかったが、0.3mg/m3および1.0mg/m3曝露群の気管支粘膜上皮細胞には多層性の増生と剥離がみられた。また、曝露群の肺門リンパ節において、黒色粒子様物質の沈着を認めた。それ以外の臓器では顕著な変化は認められなかった。
5)動脈血pH、ガス分圧の変化と肺におけるガス交換能の変化(図4)
安静時にカテーテル法によって採取した動脈血のpHとガス分圧を測定した。pHは3mg/m3曝露で有意に低下し、二酸化炭素分圧は有意に増加し、酸素分圧は1mg/m3と3mg/m3曝露群で有意に低下した。これらのpHと動脈血ガス分圧の変化は、肺による換気機能の低下を示唆した。
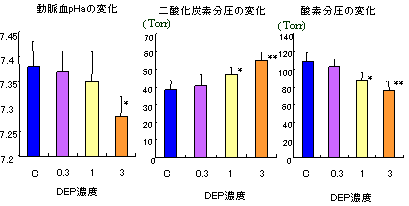
*p<0.05,**p<0.01
(2)DEPの静脈内投与による血圧および心電図の変化
DEもしくはその中に含まれるDEPが循環機能に対し、何らかの影響を及ぼしていることが推察されたので、麻酔下のラットの静脈内にDEP溶液を投与し、血圧と心電図の変化を観察したところ、DEP溶液の投与により血圧の一過性の低下が認められた。血圧の低下にはDEPの濃度依存性の反応が認められた。また、本実験において、DEP溶液の投与により吸入曝露と同様の心室性期外収縮が出現し、これはDEPの心筋への直接作用か、自律神経系を介した作用によると考えられた。
(3)PM2.5(DEP)の心血管系に対する薬理学的作用
DEP懸濁溶液をモルモットの静脈に累積投与する事によって、心房の電気的な刺激が心室に正常に伝わらないいわゆる房室ブロック(A-V block)が誘発され、最終的には心活動が停止した。この時の不整脈誘発濃度は75.53±11.65mg/mlで、致死濃度は132.0±7.22mg/mlであることが明らかとなった。
(4)DEPの摘出血管標本および摘出心筋標本に対する直接作用
ここでは、心臓と血管の摘出標本を用いて、DEPの血管および心臓に対する直接的作用を明らかにするため、血管を収縮させる薬物(PE)によって収縮中の血管にDEP溶液を投与したところ、高濃度の10mg/mlでは明瞭な弛緩作用が出現した。心筋作用に関しては、心筋単収縮の抑制とそれに続く強縮が出現することが明らかになった。これらの組織標本を用いた実験結果から、DEPの循環器系に対する作用は、血管の弛緩と心拍動の抑制による血圧低下ならびに心拍出量の減少をもたらすものと解釈された。
(5)DEP中のどのような物質が血管と心臓にどのような作用を持つか。
DEP溶液を系統的に抽出分画し、血管反応と心臓反応を指標に、さらに細分画していく方法で、DEP中のどのような物質が心・血管にどのような作用を持つのかを明らかにするために、血管と心筋の摘出標本に対する作用の検索とDEPの細分画化を繰り返し行い、最終的に、血管・心臓作用を持つ細分画から5種類の化学物質が抽出、単離された。
(6)化学物質Bの静脈内投与による反応
前節で分離された化学物質B(5種類の代表として)の静脈内投与実験で、全DEPの静脈内投与実験の時と同様の、一過性の血圧低下と心室性期外収縮が認められた。よって、この化学物質Bは全DEPの投与と同様の生体反応を引き起こすこと、すなわち生体に対し血圧低下や異常心電図の出現の原因となる物質であることが明らかとなった。
(7)化学物質Bの血管弛緩作用および心臓強縮作用の特徴
この物質による血管の弛緩に内皮細胞の血管弛緩因子が関与していることと、弛緩因子が関与しない弛緩もが存在することが推測された。心筋に対しては、交感神経のレセプターを薬物で完全に遮断しても、この化学物質Bによって、収縮力の減少と強縮は引き起こされ、交感神経のレセプターは心筋の反応に関与していないことが判明した。
(8)培養細胞系—血管内皮細胞に及ぼす傷害作用
DEPの血管内皮細胞に対する傷害作用について、培養細胞を用いた実験により、SODとCATの作用によって、DEPの血管内皮細胞への毒性のメカニズムが考えられた。
(9)肺胞上皮細胞と肺微小血管内皮細胞、肺線維芽細胞への影響
同様に、DEPの肺構成細胞にたいする影響を検討した結果、1)生体組織を模して基底膜やI型コラーゲンゲル中で培養した場合、従来のプラスチック上での培養よりもDEP抽出物曝露に対する細胞の抵抗性が強いこと、2)低濃度のDEPは肺線維芽細胞の増殖を引き起こすこと、3)DEPによる細胞障害作用機序として酸化的ストレスが関与していることが示された。
II 免疫学的影響研究
(1)DEP曝露マウス由来肺胞マクロファージに関する免疫学的研究
DEPと肺胞マクロファージの関係を知るために肺胞マクロファージを採取し、様々の性質を調べた。DEPを長期間曝露されたマウス由来の肺胞マクロファージはサイトカイン産生が低下していた。また、脾細胞を用いたDNA合成実験では、高濃度DEPの長期間曝露群で有意にDNA合成が抑制された
(2)DEP曝露マウスと結核感染との関係に関する基礎的研究
DEP曝露マウスが結核菌に感染された時、どのように病態が変化するかを調べた。結果から長期DEP曝露マウスは結核にかかりやすいといえそうである。しかも結核菌に対する防御反応である肉芽腫形成が長期曝露マウスで認めにくくなる。
(3)DEPのマクロファージ・リンパ球機能の障害
特異抗体処理によってTリンパ球を除いた系にDEPを投与し、その影響を解析した。その結果、DEPの曝露は、マクロファージや陽性Tリンパ球への影響を通じて局所での炎症の増悪に関与し、血中での抗体レベルにも影響を与えることにより血管系への障害にも関与する可能性が示唆された。
(4)DEP中の化学成分による肥満細胞機能の障害
DEP成分に含まれるベンゾ(a)ピレンと1-二トロピレンは低濃度で活性化した培養肥満細胞からのサイトカイン産生を亢進させることが示唆された。
(5)DEにより誘導される肺胞マクロファージの遺伝子の解析
毒性に関する遺伝子の解析により、DEP抽出物の曝露は、一部の抗酸化系酵素と、DNAの修復と複製に関わる遺伝子の発現を増加させることを明らかにした。これよりDEPに対する肺胞マクロファージの初期反応は、生体の防御機構が作動する可能性が示唆された。
(6)DE曝露が花粉症および目のアレルギーにおよぼす影響
ディーゼル排気をはじめとした大気汚染物質の曝露下に抗原が投与されると、くしゃみや鼻水といった鼻アレルギー、結膜の充血等の眼のアレルギーの症状を増悪し、増悪作用の要因として鼻や眼の過敏、抗体産生の増加、好酸球の浸潤の増加などが示唆された。
(7)DEPによる感染性肺傷害の増悪とメカニズムの解明に関する研究(図5)
動物モデルを用いた実験において、DEPは細菌毒素(LPS)による肺傷害を相乗的に増悪した。肺傷害は、間質性肺水腫、肺胞出血を伴う好中球性炎症であった。この増悪効果は、炎症性タンパク質の上昇とよく相関し、これらの炎症性タンパクの増加が増悪メカニズムの中心的役割を果たしていると考えられた。
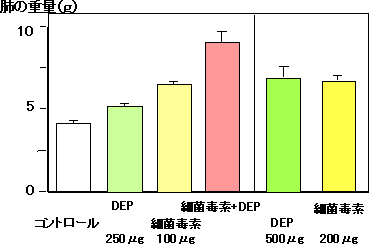
III 生殖器への影響
DE曝露が生殖器に及ぼす影響をDE吸入曝露により調べた。DE中の粒子濃度が0.3、1.0および3.0mg/m3の3群と対照群(清浄空気のみ)をおき、曝露期間は約4ヶ月間(午後10時から午前10時まで12時間/日、7日/週)とした。さらに次世代影響を調べるために曝露終了後、曝露されていない10週齢の雄と一週間同居交配させた。その結果、母マウスの流産や娩出不全等の繁殖異常が認められたが有意ではなかった。しかし、親の営巣行動は正常出産雌に比較して有意に低下した。また、出生子の体重変化は、成長するにしたがって雌雄ともに高濃度曝露群で有意に減少した。また、雌子マウスにおける腟開口時期については、0.3および1.0mgDEP/m3群で有意に早まり、次世代にわたる間接的な影響が示唆された。
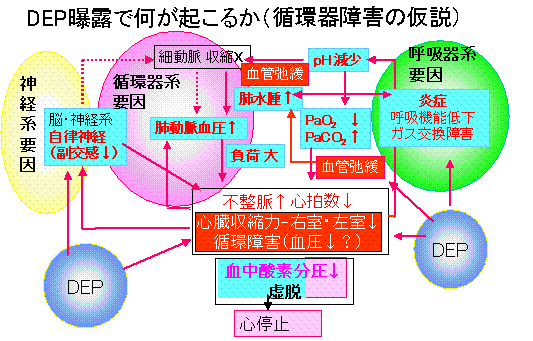
まとめ
DEあるいはDEPの曝露によって、ガス交換障害を主とする呼吸機能の低下が起こり、それに伴い、動脈血液中の酸素分圧の低下および二酸化炭素分圧の増加が起こることが確認された。また、これらの変化は、心臓負荷を増大させ、循環機能の低下をもたらすことが、右心室壁の肥厚や不整脈の出現によって明らかにされた。さらに、DEP曝露は、生体の免疫力を低下させ、細菌感染を起こりやすくし、細菌の出す毒素を増悪させることが判明した。細菌毒素による炎症の悪化は肺水腫や肺での循環障害を引き起こすことから、心臓と血管の負荷を大きくする可能性がある。さらに、DEP中に血管弛緩と心筋強縮作用をもつ化学物質が存在することがはじめて確認されたことから、循環器の障害は極めて大きくなることが推察された。なお、DEP中から単離、同定された5種類の化学物質についてはPM2.5・DEP研究プロジェクトの研究の中で詳細に検討される予定である。
3. 今後の検討課題
本特別研究は、PM2.5(DEP)の呼吸・循環器への影響とそれに関する免疫学的影響に焦点を当てたが、この研究成果は、重点特別研究プロジェクト「PM2.5・DEP研究プロジェクト」(平成13~17年度)に引き継がれることになる。大気中の微小粒子の生体影響に関する研究、特に循環器影響に関する研究は始まったばかりと言っても過言ではなく、その粒子がナノ粒子のように小さくなればなるほど、生体内に吸収される量が多くなると推測されるため重要な研究である。特に、微小粒子の生体内動態は不明の点が多く、また、その化学的性質も不明な点が多い。本研究において5種類の心臓・血管作用物質が発見されたが、これらの生体内動態も含めて、より詳細な研究が必要になる。また、動物実験の結果をヒトに外挿するための研究も必要になってくるだろう。一方、疫学研究の結果との比較検討は現実社会の影響と動物実験の結果の違いを明らかにするために必要である。さらに、同定された化学物質を含む微粒子の発生源と広域移動、および曝露量とその曝露形態を把握することが、微小粒子の健康影響を防止するために必要になってくると考えられる。「PM2.5・DEP研究プロジェクト」には、発生源、環境動態、分析化学、疫学、毒性・影響評価等々の専門家がいるので、広範な研究協力を行うことによって、これらの問題を総合的に解決することが期待される。
独立行政法人国立環境研究所
PM2.5・DEP研究プロジェクト 鈴木明
Tel.0298-50-2461, Fax.0298-50-2461
用語解説
-
SPM (Suspended particulate matters):浮遊粒子状物質、一般に大気中に浮遊している粒子の総称であり、10ミクロン(百分の1mm)位の大きな花粉から、土壌由来の砂、海塩、エンジン排気中の小さい粒子までを含む。日本のSPMは10ミクロン以下と定義されている。
-
PM2.5:正確には、空気力学的直径が2.5ミクロン(千分の2.5mm)以下の粒子を示し、直径が2.5ミクロンより大きい粒子も含まれるが、一般的には、測定手法上直径が2.5ミクロン以下の粒子と考えられている。
-
DE (Diesel exhaust),DEP (Diesel exhaust particles):一般的に、ディーゼルエンジンから排出されるガス体と粒子を含めた排気ガスをDEといい、その中の粒子をディーゼル排気粒子、DEPという。また、国によってはDPMと略すところもある。
-
心室性期外収縮と房室ブロック(AV ブロック):心臓は2つの心房と2つの心室からできており、電気刺激は心房から心室へリズミカルに伝わることによって、正常な心拍が維持されている。この電気刺激の伝播が何らかの影響を受けたときに異常心電図が発現する。心室が心房からの刺激と関係なく収縮することを心室性期外収縮といい、心房からの電気刺激が心室に正常に届かず、心房は収縮するが心室の収縮が起きないことを房室ブロックという。いずれの場合も、脈拍はないので、心臓からの血液の拍出はない。
-
SODとCAT:SODはスーパー・オキシ・ディスムターゼといい、CATはカタラーゼのことである。細胞は有害な活性酸素の攻撃を受けると、SODを使用して過酸化水素水に変え、これをCATが無害な水に変える。酸化的ストレスに対抗する防御システムのひとつである。
-
マクロファージ:白血球の一種で、細菌や異物が体内に入ってきたときに、それらを取り込み無害化する細胞である。
-
サイトカイン:さまざまな生体機能の形成・維持に必須の役割を果たしている生体物質の総称で、細菌などが体内に入った時、免疫反応として炎症などが起きるが、そのとき細胞から放出される物質で、生体反応の指標となる。








.jpg)














